Proprietățile fizice și chimice ale benzenului. Reactivitatea omologilor benzenului V
Proprietăți fizice
Benzenul și omologii săi cei mai apropiați sunt lichide incolore cu un miros specific. Hidrocarburile aromatice sunt mai ușoare decât apa și nu se dizolvă în ea, dar sunt ușor solubile în solvenți organici - alcool, eter, acetonă.
Benzenul și omologii săi sunt ei înșiși buni solvenți pentru multe substanțe organice. Toate arenele ard cu o flacără fumurie datorită conținutului ridicat de carbon din moleculele lor.
Proprietățile fizice ale unor arene sunt prezentate în tabel.
Masa. Proprietățile fizice ale unor arene
|
Nume |
Formulă |
t°.pl., |
t°.b.p., |
|
Benzen |
C6H6 |
5,5 |
80,1 |
|
Toluen (metilbenzen) |
C6H5CH3 |
95,0 |
110,6 |
|
Etilbenzen |
C6H5C2H5 |
95,0 |
136,2 |
|
Xilen (dimetilbenzen) |
C6H4(CH3)2 |
||
|
orto- |
25,18 |
144,41 |
|
|
meta- |
47,87 |
139,10 |
|
|
pereche- |
13,26 |
138,35 |
|
|
Propilbenzen |
C6H5(CH2)2CH3 |
99,0 |
159,20 |
|
Cumen (izopropilbenzen) |
C6H5CH(CH3)2 |
96,0 |
152,39 |
|
Stiren (vinilbenzen) |
C6H5CH=CH2 |
30,6 |
145,2 |
Benzen – fierbere scăzută ( tbalot= 80,1°C), lichid incolor, insolubil în apă
Atenţie! Benzen – otravă, afectează rinichii, modifică formula sanguină (cu expunere prelungită), poate perturba structura cromozomilor.
Majoritatea hidrocarburilor aromatice pun viața în pericol și sunt toxice.
Prepararea arenelor (benzen și omologii săi)
In laborator
1. Fuziunea sărurilor acidului benzoic cu alcalii solide
C6H5-COONa + NaOH t → C6H6 + Na2CO3
benzoat de sodiu
2. Reacția Wurtz-Fitting: (aici G este halogen)
C 6H 5 -G + 2N / A + R-G →C 6 H 5 - R + 2 N / AG
CU 6 H5-Cl + 2Na + CH3-Cl → C6H5-CH3 + 2NaCl
În industrie
- izolat din petrol și cărbune prin distilare și reformare fracționată;
- din gudronul de cărbune și gazul cuptorului de cocs
1. Dehidrociclizarea alcanilor cu mai mult de 6 atomi de carbon:
C6H14 t , kat→C6H6 + 4H2
2. Trimerizarea acetilenei(doar pentru benzen) – R. Zelinsky:
3С 2 H 2 600°C, Act. cărbune→C6H6
3. Dehidrogenare ciclohexan și omologii săi:
Academicianul sovietic Nikolai Dmitrievich Zelinsky a stabilit că benzenul se formează din ciclohexan (dehidrogenarea cicloalcanilor
C6H12 t, kat→C6H6 + 3H2

C6H11-CH3 t , kat→C6H5-CH3 + 3H2
metilciclohexantoluen
4. Alchilarea benzenului(prepararea omologilor benzenului) – r Friedel-Crafts.
C6H6 + C2H5-CI t, ACI3→C6H5-C2H5 + HCI
cloretan etilbenzen

Proprietățile chimice ale arenelor
eu. REACȚII DE OXIDARE
1. Arderea (flacără de fum):
2C6H6 + 15O2 t→12CO2 + 6H2O + Q
2. În condiții normale, benzenul nu decolorează apa cu brom și soluție de apă permanganat de potasiu
3. Omologii benzenului sunt oxidați de permanganat de potasiu (permanganat de potasiu decolorat):
A) într-un mediu acid la acidul benzoic
Când omologii benzenului sunt expuși la permanganat de potasiu și la alți agenți oxidanți puternici, lanțurile laterale sunt oxidate. Indiferent cât de complexă este lanțul substituentului, acesta este distrus, cu excepția atomului de carbon a, care este oxidat într-o grupare carboxil.
Omologii benzenului cu un lanț lateral dau acid benzoic:
Omologuri care conțin două lanțuri laterale dau acizi dibazici:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 +28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 +14H 2 O
Simplificat :
C6H5-CH3+3O KMnO4→C6H5COOH + H2O
B) în săruri neutre și ușor alcaline până la benzoic
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO K + K OH + 2MnO2 + H2O
II. REACȚII SUPLIMENTARE (mai greu decât alchenele)
1. Halogenare
C6H6+3CI2 h ν → C6H6CI6 (hexaclorociclohexan - hexacloran)
2. Hidrogenarea
C6H6 + 3H2 t , PtsauNi→C6H12 (ciclohexan)
3. Polimerizare
III. REACȚII DE SUBSTITUȚIE – mecanism ionic (mai usor decat alcanii)
b) omologi de benzen la iradiere sau încălzire
Proprietățile chimice ale radicalilor alchil sunt similare cu alcanii. Atomii de hidrogen din ei sunt înlocuiți cu halogen printr-un mecanism de radicali liberi. Prin urmare, în absența unui catalizator, la încălzire sau la iradiere UV, are loc o reacție de substituție radicală în lanțul lateral. Influența inelului benzenic asupra substituenților alchil duce la faptul că Atomul de hidrogen este întotdeauna înlocuit la atomul de carbon legat direct de inelul benzenic (a-atomul de carbon).
1) C6H5-CH3 + CI2 h ν → C6H5-CH2-CI + HCI
c) omologi de benzen în prezenţa unui catalizator
C6H5-CH3 + CI2 AlCl 3 → (amestec orta, pereche de derivați) +HCl
2. Nitrare (cu acid azotic)
C6H6 + HO-NO2 t, H2S04→C6H5-NO2 + H2O
nitrobenzen - miros migdale!
C6H5-CH3 + 3HO-N02 t, H2S04→ CU H3-C6H2 (N02)3 + 3H202,4,6-trinitrotoluen (tol, TNT)
Aplicarea benzenului și a omologilor săi
Benzen C6H6 este un solvent bun. Benzenul ca aditiv îmbunătățește calitatea combustibilului pentru motor. Servește ca materie primă pentru producerea multor compuși organici aromatici - nitrobenzen C 6 H 5 NO 2 (solvent din care se obține anilina), clorbenzen C 6 H 5 Cl, fenol C 6 H 5 OH, stiren etc.
Toluen C 6 H 5 –CH 3 – solvent, utilizat la producerea coloranților, medicinali și explozivi (TNT (TNT), sau 2,4,6-trinitrotoluen TNT).
Xilenii C6H4(CH3)2. Xilenul tehnic este un amestec de trei izomeri ( orto-, meta- Și pereche-xilen) – folosit ca solvent și produs inițial pentru sinteza multor compuși organici.
Izopropilbenzen C 6 H 5 –CH(CH 3) 2 este folosit pentru a produce fenol și acetonă.
Derivați clorurati ai benzenului folosit pentru protectia plantelor. Astfel, produsul înlocuirii atomilor de H din benzen cu atomi de clor este hexaclorbenzenul C 6 Cl 6 - un fungicid; este folosit pentru tratarea uscată a semințelor de grâu și secară împotriva scoicii. Produsul adăugării clorului la benzen este hexaclorciclohexan (hexacloran) C 6 H 6 Cl 6 - un insecticid; este folosit pentru combaterea insectelor dăunătoare. Substantele mentionate apartin pesticidelor - mijloace chimice de combatere a microorganismelor, plantelor si animalelor.
Stiren C 6 H 5 – CH = CH 2 polimerizează foarte uşor, formând polistiren, iar la copolimerizarea cu butadienă, cauciucuri stiren-butadienă.
EXPERIENȚE VIDEO
Omologii benzenului sunt capabili să reacționeze în două direcții cu participarea unui miez aromatic și a unei catene laterale (grupe alchil), în funcție de natura reactivului.
1.Reacții pe inelul aromatic
Datorită efectului donor al grupării alchil, reacțiile S E ArH au loc orto- Și pereche-pozitia inelului aromatic, in timp ce conditiile sunt mai blande decat la benzen.
a) halogenare

b) nitrare


Observați cum, pe măsură ce crește numărul de grupări acceptoare (-NO2), temperatura reacțiilor de nitrare crește.
c) sulfonare

Reacția produce predominant P-izomer.
d) alchilare

e) acilare

2. Reacții laterale în lanț
Fragmentul alchil al moleculei de benzen intră în reacții S R care implică atomul de carbon din α -pozitia (pozitia benzilica).


Oxidarea tuturor omologilor benzenului cu KMnO 4 /100°C duce la formarea acidului benzoic.
Arene condensate

Arenele condensate sunt sisteme aromatice (n=2 și 3). Gradul de aromaticitate al arenelor condensate este mai mic decât al benzenului. Se caracterizează prin reacții de substituție electrofilă, reacții de adiție și oxidare, care au loc în condiții mai blânde decât pentru benzen.
Reactivitatea naftalinei
Reacțiile S E ArH pentru naftalină se desfășoară în principal conform α -poziţie, cu excepţia sulfonării. Adăugarea electrofilă de Ad E are loc în pozițiile 1,4, naftalina prezentând proprietățile dienelor conjugate.
1. Reacții de substituție electrofilă,S E ArH


2. Reacții de adiție, reducere și oxidare electrofilă.


Reactivitatea antracenului și a fenantrenului
Reacțiile de substituție electrofilă, S E ArH și adiție electrofilă, Ad E pentru antracen apar predominant la pozițiile 9 și 10 (vezi diagrama de mai jos).

Reacțiile de substituție electrofilă, S E ArH și adiție electrofilă, Ad E pentru fenantren apar predominant în pozițiile 9 și 10, ca și pentru antracen (vezi diagrama de mai jos).

Reacții de oxidare și reducere pentru antracen și fenantren.


Structuri ale unora medicamente pe bază de naftalină, antracen și fenantren
Naftizină(nafazolina, sanorin)

efect vasoconstrictor(tratamentul rinitei, sinuzitei)
(structura originală este subliniată în titlu, atenție la numerotare)
Naftifin

antifungic acțiune (tratamentul dermatitei)
Nabumethon

efect antiinflamator, antipiretic, analgezic(tratamentul osteoartritei, al artritei reumatoide).
Nadolol

(termenul cis, în acest caz, desemnează poziția relativă a grupărilor hidroxil)
hipotensiv(coboară presiunea arterială) Și efect antiaritmic
Morfina, codeina

Întrebări de test pentru capitolul „ARENAS”
1. Ce proprietăți ale benzenului îl deosebesc de alți compuși nesaturați - alchene, alchine? Ce înseamnă termenul „compus aromatic”?
2. Scrieţi formulele structurale ale compuşilor: a) etilbenzen; b) 1,3-dimetilbenzen ( m -xilen); c) 1,3,5-trimetilbenzen (mesitylen); d) izopropilbenzen (cumen); e) 3-fenilpentan; f) vinilbenzen (stiren); g) fenilacetilenă; h) transă -difeniletilena ( transă -stilben).
3. Caracterizați caracteristicile structurale ale compușilor care prezintă aromaticitate. Formulați regula lui Hückel. Care dintre următorii compuși sunt aromatici:

4. Comparați raportul dintre ciclohexenă și benzen cu următorii reactivi în condițiile indicate : a) Br 2 (H 2 O, 20 C); b) KMnO 4 (H 2 O.0 C); c) N 2 ASA DE 4 (conc.), 20 C; d) H 2 (Pd, 30 C); inainte de 3 , apoi H 2 O(Zn); f) HBr.
5. Scrieți formulele structurale ale benzenilor monosubstituiți formați în reacțiile benzenului cu următorii reactivi: a) N 2 ASA DE 4 (conc.); b) HNO 3 ; N 2 ASA DE 4 (conc.); c) Br 2 /Fe; d) Cl 2 /AlCl 3 ; e) CH 3 Br/AlBr 3 ; e) CH 3 COCl/AlСl 3 . Numiți reacțiile și produsele lor. Indicați cu ce benzen electrofil reacționează în fiecare caz specific.
6. Dați o schemă generală pentru interacțiunea benzenului cu un reactiv electrofil ( E + ). Numiți complexele intermediare. Care pas determină de obicei viteza unei reacții? Dați un grafic al modificării energiei potențiale a reacției luate în considerare.
7. Definiţi următoarele concepte: a) stare de tranziţie; b) racord intermediar; c) -complex; d)-complex. Care dintre ele sunt identice? Ilustrați aceste concepte folosind exemplul de bromurare a benzenului în prezența unui catalizator. feBr 3 .
8. Folosind exemplul reacțiilor etenei și benzenului cu brom, se compară mecanismul de adiție electrofilă în alchene cu mecanismul de substituție electrofilă din seria aromatică. În ce stadiu se observă diferența și de ce?
9. Folosind efecte inductive și mezomerice, descrieți interacțiunea substituentului cu inelul benzenic din compușii indicați:

Etichetați substituenții care donează electroni (ED) și care atrag electroni (EA).
10. Scrieţi scheme de mononitrare a compuşilor: a) fenol; b) acizi benzensulfonici; c) izopropilbenzen; d) clorbenzen. Pentru ce compus ar trebui rata relativă de substituție să fie cea mai mare și de ce?
11. Formarea a ce produse ar trebui să fie de așteptat în timpul monosulfonării compușilor: a) toluen; b) nitrobenzen; c) acid benzoic; d) bromobenzen? Care compus ar trebui să sulfonate cel mai ușor? De ce?
12. Aranjați următorii compuși în ordinea creșterii reactivității la bromurarea lor într-un inel benzenic: a) benzen; b) fenol; c) benzaldehidă; d) etilbenzen. Dă o explicație.
13. Numiți următoarele hidrocarburi:

14. Scrieți reacțiile benzenului cu următorii reactivi : a) Cl 2 (Fe); b) 3Cl 2 (ușoară); c) HNO 3 (H 2 ASA DE 4 ); d) O 2 (aer) (V 2 DESPRE 5 , 450 C); e) 3O 3 , apoi N 2 O (Zn); e) H 2 ASA DE 4 (oleum); g) 3H 2 (Ni, 200 C,p ). Care sunt caracteristicile reacțiilor de adiție în benzen?
15. Scrieți reacțiile toluenului cu reactivii indicați : a) 3H 2 (Ni, 200 C, 9806,7 kPa); b) KMnO 4 V N 2 DESPRE; c*) Cl 2 , ușoară; d*) Cl 2 (Fe); e*) CH 3 Cl(AlCl 3 ); e*) CH 3 COCl (AlCl 3 ); g) HNO 3 (H 2 ASA DE 4 ). Pentru reacțiile marcate cu un asterisc, indicați mecanismele.
16. Scrieți reacțiile de nitrare a etilbenzenului în condițiile indicate: a) 65% HNO 3 +H 2 ASA DE 4 (conc.); b) 10% HNO 3 , încălzire, presiune. Aduceți mecanismele.
17. Comparați raportul dintre izopropilbenzen și brom: a) în prezență AlBr 3 ; b) sub iluminat si incalzire. Prezentați reacțiile și mecanismele acestora.
18. Ce compuși se formează din etilbenzen și P -xilen sub actiunea agentilor oxidanti indicati: a) O 3 , apoi H 2 O (Zn); b) KMnO 4 în H 2 DESPRE,t ; VC 2 Cr 2 O 7 în H 2 ASA DE 4 , t ?
19. Prin ce reacții se pot distinge următoarele perechi de compuși: a) etilbenzen și m -xilen; b) etilbenzen şi stiren; c) stiren şi fenilacetilenă; G) O - Și P -xilene?
20. Ce compuși sunt produșii reacțiilor de mai jos:

21. Pe baza benzenului și a oricăror alți reactivi, obțineți compușii de mai jos: a) P -freacă -butiltoluen; b) etil- P -tolil cetonă; c) alilbenzen; G) P -acid bromobenzoic.
22. Numiți principalii compuși formați în următoarele reacții:

Hidrocarbură simplă. Aparține hidrocarburilor aromatice, o clasă de substanțe organice.
Substanța este un lichid transparent, nu are culoare și are un miros caracteristic dulceag. Benzenul este clasificat ca o hidrocarbură nesaturată. Celebra formulă a inelului benzenic a fost propusă de laureatul Nobel pentru chimie, Linus Pauling. El a sugerat să descrie benzenul ca un hexagon cu un cerc înăuntru. Această imagine oferă o înțelegere a absenței legăturilor duble și a prezenței unui singur nor de electroni, care acoperă toți cei 6 atomi de carbon.
Formulă
Obținerea benzenului
Surse naturale
O sursă naturală de benzen este cărbunele. Procesul de cocsificare a cărbunelui a fost descoperit de Michael Faraday în 1825. El a studiat gazul de iluminat folosit în lămpile stradale și a putut să izoleze și să descrie benzenul. În zilele noastre, benzenul nu este practic obținut din gudron de cărbune folosind această metodă. Există multe alte modalități mai productive de a-l obține.
Surse artificiale de obținere
- Reformarea catalitică artificială a benzinei. Fracțiunile de petrol din benzină sunt utilizate pentru producție. Acest proces produce cantități mari de toluen. Nu există o cerere prea mare pe piață pentru toluen, așa că și benzenul este produs în continuare din acesta. Benzenul este obținut din fracțiunile de petrol grele prin piroliză prin procesul de dezalchilare a unui amestec de toluen și xilen.
- Preparare prin metoda Reppe. Până în 1948, benzenul a fost obținut prin metoda Berthelot prin trecerea acetilenei peste cărbune activ la o temperatură de 400°C. Randamentul de benzen a fost mare, dar rezultatul a fost un amestec multicomponent de substanțe greu de purificat. În 1948, Reppe a înlocuit cărbunele activ cu nichel. Rezultatul a fost benzenul. Procesul este numit trimerizarea acetilenei– trei molecule de acetilenă sunt transformate într-un singur benzen:
3C2H2 → C6H6.
Proprietățile benzenului
Proprietăți fizice
Când este arsă, se eliberează o cantitate mare de funingine, deoarece hidrocarbura este nesaturată (îi lipsesc 8 atomi de hidrogen pentru a îndeplini formula standard pentru hidrocarburile saturate). La temperaturi scăzute benzenul devine o masă cristalină albă.
Proprietăți chimice
Benzenul suferă reacții de substituție în prezența catalizatorilor - de obicei săruri de Al(3+) sau Fe(3+):
- halogenare - reacție calitativă pentru benzen cu Br 2:
C6H6 + Br2 = C6H5Br + HBr.
- Nitrarea este interacțiunea cu acidul azotic. ÎN Chimie organica acest proces este însoțit de eliminarea grupei OH:
C6H6 + HO-NO2 → C6H5NO2 + H2O.
- Alchilarea catalitică duce la producerea de omologi de benzen - alchilbenzeni:
C6H6 + C2H5CI → C6H5C2H5 + HCI.
Omologii benzenului care conțin un radical reacționează diferit față de benzenul însuși. Reacțiile merg diferit și adesea în lumină:
- halogenare C6H5-CH3 + Br2 (la lumină) = C6H5-CH2Br + HBr;
- nitrare – C 6 H 5 -CH 3 + 3HNO 3 → C 6 H 2 CH 3 (NO 2) 3.
Reacțiile de oxidare ale benzenului sunt foarte complexe și nu sunt tipice pentru această substanță. Oxidarea este tipică pentru omologi. Iată, de exemplu, reacția de producere a acidului benzoic:
C6H5CH3 + [O] → C6H5COOH.
Procesul de ardere al unei substanțe are loc conform schemei standard pentru toate substanțele organice:
C n H 2n-6 + (3n-3)\2 O 2 → nCO 2 + (n-3)H 2 O.
Reacții de hidrogenare. Reacția este complicată; sunt necesari catalizatori, presiune și temperatură. Reacțiile benzenului cu hidrogenul produc ciclohexan:
C6H6 + 3H2 → C6H12.
Și în reacțiile cu alchilbenzen - metilciclohexan, în care un atom de hidrogen este înlocuit cu o grupare radicală -CH 3:
C6H5CH3 + 3H2 → C6H11-CH3.
Aplicații ale benzenului
Benzenul în forma sa pură nu este practic utilizat niciodată. Este produs pentru a produce alți compuși importanți, cum ar fi etilbenzenul, din care se obține stirenul și polistirenul.
Cea mai mare parte a benzenului este folosită pentru a produce fenol, care este necesar în producția de nailon, coloranți, pesticide și medicamente. Faimosul medicament aspirina nu poate fi obținut fără participarea fenolului.
Ciclohexanul din benzen este necesar pentru producerea materialelor plastice și a fibrelor artificiale;
Primul grup de reacții sunt reacții de substituție. Am spus că arenele nu au legături multiple în structura moleculei, dar conțin un sistem conjugat de șase electroni, care este foarte stabil și oferă o rezistență suplimentară inelului benzenic. Prin urmare în reacții chimiceÎn primul rând, are loc înlocuirea atomilor de hidrogen, mai degrabă decât distrugerea inelului benzenic.
Am întâlnit deja reacții de substituție când vorbim despre alcani, dar pentru ei aceste reacții au urmat un mecanism radical, în timp ce arenele sunt caracterizate printr-un mecanism ionic de reacții de substituție.
Primul proprietăți chimice halogenare. Înlocuirea unui atom de hidrogen cu un atom de halogen, clor sau brom.
Reacția are loc atunci când este încălzită și întotdeauna cu participarea unui catalizator. În cazul clorului, ar putea fi clorură de aluminiu sau clorură ferică trei. Catalizatorul polarizează molecula de halogen, determinând clivajul legăturii heterolitice și producând ioni.
Clorul este un ion încărcat pozitiv și reacționează cu benzenul.
Dacă reacția are loc cu brom, atunci catalizatorul este bromură de fier sau bromură de aluminiu.

Este important de menționat că reacția are loc cu bromul molecular și nu cu apa cu brom. Benzenul nu reacționează cu apa cu brom.
Halogenarea omologilor benzenului are propriile sale caracteristici. În molecula de toluen, gruparea metil facilitează substituția în inel, reactivitatea crește, iar reacția are loc în condiții mai blânde, adică la temperatura camerei.

Este important de menționat că substituția are loc întotdeauna în pozițiile orto și para, astfel încât se obține un amestec de izomeri.
Al doilea proprietăți nitrarea benzenului, introducerea unei grupări nitro în inelul benzenic.

Un lichid greu gălbui cu miros de migdale amare se formează nitrobenzen, astfel încât reacția poate fi calitativă la benzen. Pentru nitrare se folosește un amestec de nitrare de acizi azotic și sulfuric concentrați. Reacția se realizează prin încălzire.
Permiteți-mi să vă reamintesc că pentru nitrarea alcanilor în reacția Konovalov a fost folosit acid azotic diluat fără adăugarea de acid sulfuric.
În timpul nitrarii toluenului, precum și în timpul halogenării, se formează un amestec de orto- și para-izomeri.

Al treilea proprietatea de alchilare a benzenului cu haloalcani.

Această reacție permite introducerea unui radical de hidrocarbură în inelul benzenic și poate fi considerată o metodă de producere a omologilor de benzen. Clorura de aluminiu este folosită ca catalizator, care favorizează descompunerea moleculei de haloalcan în ioni. Încălzirea este, de asemenea, necesară.
Al patrulea proprietatea de alchilare a benzenului cu alchene.

În acest fel se poate obține, de exemplu, cumen sau etilbenzen. Catalizator clorură de aluminiu.
2. Reacții de adiție la benzen
Al doilea grup de reacții sunt reacțiile de adiție. Am spus că aceste reacții nu sunt tipice, dar sunt posibile în condiții destul de stricte cu distrugerea norului pi-electron și formarea de legături șase sigma.
a cincea proprietate în lista generală hidrogenare, adăugare de hidrogen.
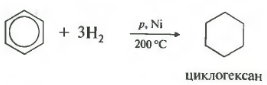
Temperatura, presiunea, catalizatorul nichel sau platina. Toluenul poate reacționa în același mod.
Şaselea clorinare de proprietate. Vă rugăm să rețineți că vorbim în mod specific despre interacțiunea cu clorul, deoarece bromul nu intră în această reacție.

Reacția are loc la greu iradierea ultravioletă. Se formează hexaclorociclohexan, un alt nume pentru hexacloran, un solid.
Este important să rețineți că pentru benzen nu este posibil reacții de adiție de halogenuri de hidrogen (hidrohalogenare) și adăugare de apă (hidratare).
3. Înlocuirea în lanțul lateral a omologilor benzenului
Al treilea grup de reacții se referă numai la omologii benzenului - aceasta este o substituție în lanțul lateral.
Al șaptelea proprietate în lista generală halogenare la atomul de carbon alfa din lanțul lateral.

Reacția are loc atunci când este încălzită sau iradiată și întotdeauna numai la carbonul alfa. Pe măsură ce halogenarea continuă, al doilea atom de halogen va reveni la poziția alfa.
4. Oxidarea omologilor benzenului
Al patrulea grup de reacții este oxidarea.
Inelul de benzen este prea puternic, deci benzen nu se oxideaza permanganatul de potasiu nu își decolorează soluția. Acest lucru este foarte important de reținut.
Dar omologii benzenului sunt oxidați de o soluție acidificată de permanganat de potasiu atunci când sunt încălzite. Și aceasta este a opta proprietate chimică.

Aceasta produce acid benzoic. Se observă decolorarea soluției. În acest caz, indiferent cât de lungă este lanțul de carbon al substituentului, acesta se rupe întotdeauna după primul atom de carbon și atomul alfa este oxidat la o grupare carboxil cu formarea acidului benzoic. Restul moleculei este oxidat la acidul corespunzător sau, dacă este doar un atom de carbon, la dioxid de carbon.
Dacă un omolog de benzen are mai mult de un substituent de hidrocarbură pe ciclul aromatic, atunci oxidarea are loc după aceleași reguli - carbonul situat în poziția alfa este oxidat.

ÎN în acest exemplu se obţine un acid aromatic dibazic, care se numeşte acid ftalic.
Aș dori în special să remarc oxidarea cumenului, izopropilbenzenului, de către oxigenul atmosferic în prezența acidului sulfuric.

Aceasta este așa-numita metodă cumenă pentru producerea fenolului. De regulă, se întâlnește această reacție în chestiuni legate de producerea de fenol. Aceasta este o metodă industrială.
Nouălea ardere de proprietate, oxidare completă cu oxigen. Benzenul și omologii săi arde până la dioxid de carbon și apă.
Să scriem ecuația de ardere a benzenului în formă generală.
Conform legii conservării masei, ar trebui să existe atâția atomi în stânga câte atomi sunt în dreapta. Pentru că în reacțiile chimice atomii nu dispar, ci pur și simplu se schimbă ordinea legăturilor dintre ei. Deci vor exista tot atâtea molecule de dioxid de carbon câte atomi de carbon există în molecula de arenă, deoarece molecula conține un atom de carbon. Adică n molecule de CO2. Vor fi de două ori mai puține molecule de apă decât atomii de hidrogen, adică (2n-6)/2, ceea ce înseamnă n-3.
Există același număr de atomi de oxigen în stânga și în dreapta. În dreapta sunt 2n din dioxid de carbon, deoarece fiecare moleculă are doi atomi de oxigen, plus n-3 din apă, pentru un total de 3n-3. În stânga există același număr de atomi de oxigen 3n-3, ceea ce înseamnă că sunt de două ori mai puține molecule, deoarece molecula conține doi atomi. Adică (3n-3)/2 molecule de oxigen.
Astfel, am compilat o ecuație pentru arderea omologilor benzenului în formă generală.
Structura ciclică a benzenului a fost propusă pentru prima dată de F.A. Kekule în 1865

Friedrich August Kekule von Stradonitz - un chimist german remarcabil al secolului al XIX-lea. În 1854 l-a descoperit pe primul compus organic, care conține sulf - acid tioacetic (acid tioetanoic). În plus, el a stabilit structura compușilor diazo. Cu toate acestea, contribuția sa cea mai faimoasă la dezvoltarea chimiei este stabilirea structurii benzenului (1866). Kekule a arătat că legăturile duble ale benzenului s-au alternat în jurul inelului (aceasta idee i-a apărut pentru prima dată într-un vis). Mai târziu, el a arătat că cele două posibile aranjamente duble legături sunt identice și că inelul benzenic este un hibrid între cele două structuri. Astfel, el a anticipat ideea de rezonanță (mezomerism), care a apărut în teorie legătură chimică la începutul anilor 1930
Dacă benzenul ar avea într-adevăr o astfel de structură, atunci derivații săi 1,2-disubstituiți ar trebui să aibă doi izomeri. De exemplu,

Cu toate acestea, niciunul dintre benzenii 1,2-disubstituiți nu poate fi izolat în doi izomeri.
Prin urmare, Kekule a sugerat ulterior că molecula de benzen există ca două structuri care se transformă rapid una în alta:

Rețineți că astfel de reprezentări schematice ale moleculelor de benzen și derivaților lor, de obicei, nu indică atomii de hidrogen atașați la atomii de carbon ai inelului benzenic.
ÎN chimia modernă molecula de benzen este considerată un hibrid rezonant al acestor două forme rezonante limitative (vezi Secțiunea 2.1). O altă descriere a moleculei de benzen se bazează pe luarea în considerare a orbitalilor săi moleculari. În Sect. 3.1 s-a indicat că electronii localizați în orbitalii de legătură sunt delocalizați între toți atomii de carbon ai inelului benzenic și formează un nor de electroni. În conformitate cu această reprezentare, molecula de benzen poate fi descrisă în mod convențional după cum urmează:
Datele experimentale confirmă prezența unei astfel de structuri în benzen. Dacă benzenul avea structura propusă inițial de Kekulé, cu trei legături duble conjugate, atunci benzenul ar trebui să sufere reacții de adiție precum alchenele. Cu toate acestea, așa cum sa menționat mai sus, benzenul nu suferă reacții de adiție. În plus, benzenul este mai stabil decât dacă ar avea trei legături duble izolate. În Sect. 5.3 s-a indicat că entalpia de hidrogenare a benzenului pentru a forma ciclohexan are un negativ mai mare.
Tabelul 18.3. Lungimea diferitelor legături carbon-carbon


Orez. 18.6. Structura geometrică a moleculei de benzen.
valoarea triplă a entalpiei de hidrogenare a ciclohexenei. Diferența dintre aceste cantități se numește de obicei entalpia de delocalizare, energia de rezonanță sau energia de stabilizare a benzenului.
Toate legăturile carbon-carbon din inelul benzenic au aceeași lungime, care este mai mică decât lungimea Conexiuni C-Cîn alcani, dar mai mare decât lungimea legăturilor C=C în alchene (Tabelul 18.3). Acest lucru confirmă faptul că legăturile carbon-carbon din benzen sunt un hibrid între legăturile simple și duble.
Molecula de benzen are o structură plată, care este prezentată în Fig. 18.6.
Proprietăți fizice
Benzen la conditii normale- un lichid incolor care îngheață la 5,5 °C și fierbe la 80 °C. Are un miros plăcut caracteristic, dar, după cum am menționat mai sus, este foarte toxic. Benzenul nu se amestecă cu apa și într-un sistem benzen, apa formează partea superioară a celor două straturi. Cu toate acestea, este solubil în solvenți organici nepolari și este el însuși un bun solvent pentru alți compuși organici.
Proprietăți chimice
Deși benzenul suferă anumite reacții de adiție (vezi mai jos), nu prezintă reactivitatea tipică alchenelor. De exemplu, nu decolorează apa de brom sau soluția de ioni. Mai mult, benzenul nu este
intră în reacții de adiție cu acizi tari, precum acidul clorhidric sau sulfuric.
În același timp, benzenul participă la o serie de reacții de substituție electrofilă. Produșii acestui tip de reacție sunt compuși aromatici, deoarece în aceste reacții se reține sistemul electronic delocalizat al benzenului. Mecanismul general de înlocuire a unui atom de hidrogen pe inelul benzenic cu un electrofil este descris în secțiune. 17.3. Exemple de substituție electrofilă a benzenului sunt reacțiile sale de nitrare, halogenare, sulfonare și Friedel-Crafts.
Nitrare. Benzenul poate fi nitrat (un grup adăugat la el) prin tratarea acestuia cu un amestec de acizi azotic și sulfuric concentrați:

Nitrobenzen
Condițiile pentru această reacție și mecanismul ei sunt descrise în secțiune. 17.3.
Nitrobenzenul este un lichid galben pal cu un miros caracteristic de migdale. Când benzenul este nitrat, pe lângă nitrobenzen, se formează și cristale de 1,3-dinitrobenzen, care este produsul următoarei reacții:

Halogenare. Dacă amestecați benzen cu clor sau brom în întuneric, nu va avea loc nicio reacție. Cu toate acestea, în prezența catalizatorilor care posedă proprietățile acizilor Lewis, în astfel de amestecuri apar reacții de substituție electrofilă. Catalizatorii tipici pentru aceste reacții sunt bromura de fier (III) și clorura de aluminiu. Acțiunea acestor catalizatori este aceea că creează polarizare în moleculele de halogen, care apoi formează un complex cu catalizatorul:
deși nu există dovezi directe că în acest caz se formează ioni liberi. Mecanismul bromării benzenului folosind bromură de fier (III) ca purtător de ioni poate fi reprezentat după cum urmează:

Sulfonare. Benzenul poate fi sulfonat (înlocuiește un atom de hidrogen cu o grupare sulfo) prin refluxarea amestecului său cu acid sulfuric concentrat timp de câteva ore. În schimb, benzenul poate fi încălzit cu grijă într-un amestec cu acid sulfuric fumos. Acidul sulfuric fumos conține trioxid de sulf. Mecanismul acestei reacții poate fi reprezentat prin diagramă

Reacții Friedel-Crafts. Reacțiile Friedel-Crafts au fost numite inițial reacții de condensare între compuși aromatici și halogenuri de alchil în prezența unui catalizator anhidru de clorură de aluminiu.
În reacțiile de condensare, două molecule de reactivi (sau un reactiv) se combină între ele, formând o moleculă dintr-un nou compus, în timp ce o moleculă a unui compus simplu, cum ar fi apa sau clorura de hidrogen, este separată (elimină) din ei.
În prezent, reacția Friedel-Crafts se numește orice substituție electrofilă a unui compus aromatic în care rolul unui electrofil este jucat de un carbocation sau un complex extrem de polarizat cu un atom de carbon încărcat pozitiv. Agentul electrofil, de regulă, este o halogenură de alchil sau o clorură a unui acid carboxilic, deși poate fi și, de exemplu, o alchenă sau un alcool. Clorura de aluminiu anhidru este de obicei utilizată ca catalizator pentru aceste reacții. Reacțiile Friedel-Crafts sunt de obicei împărțite în două tipuri: alchilare și acilare.
Alchilare. În acest tip de reacție Friedel-Crafts, unul sau mai mulți atomi de hidrogen de pe ciclul benzenic sunt înlocuiți cu grupări alchil. De exemplu, când un amestec de benzen și clormetan este încălzit ușor în prezența clorurii de aluminiu anhidru, se formează metilbenzen. Clormetanul joacă rolul unui agent electrofil în această reacție. Este polarizat de clorură de aluminiu în același mod ca moleculele de halogen:
Mecanismul reacției luate în considerare poate fi prezentat după cum urmează:

Trebuie remarcat faptul că în această reacție de condensare între benzen și clormetan se elimină o moleculă de acid clorhidric. Rețineți, de asemenea, că existența reală a carbocationului metalic sub formă de ion liber este îndoielnică.
Alchilarea benzenului cu clormetan în prezența unui catalizator - clorură de aluminiu anhidru nu are ca rezultat formarea de metilbenzen. În această reacție, are loc o alchilare suplimentară a inelului benzenic, conducând la formarea 1,2-dimetilbenzenului:

Acilare. În acest tip de reacție Friedel-Crafts, un atom de hidrogen de pe inelul benzenic este înlocuit cu o grupare acil, rezultând formarea unei cetone aromatice.
Gruparea acil are formula generală
Denumirea sistematică a unui compus acil se formează prin înlocuirea sufixului și terminației -ova în numele acidului carboxilic corespunzător, din care acest compus acil este un derivat, cu sufixul -(o) yl. De exemplu

Acilarea benzenului se realizează folosind clorura sau anhidrida oricărui acid carboxilic în prezența unui catalizator, clorură de aluminiu anhidru. De exemplu

Această reacție este o condensare în care se elimină o moleculă de clorură de hidrogen. Rețineți, de asemenea, că numele "fenil" este adesea folosit pentru a se referi la inelul benzenic în compușii în care benzenul nu este grupul principal:

Reacții de adaos. Deși benzenul este cel mai caracterizat prin reacții de substituție electrofilă, el suferă și unele reacții de adiție. Ne-am întâlnit deja pe unul dintre ei. Vorbim despre hidrogenarea benzenului (vezi secțiunea 5.3). Când un amestec de benzen și hidrogen este trecut pe suprafața unui catalizator de nichel fin măcinat la o temperatură de 150-160 °C, are loc o întreagă secvență de reacții, care se termină cu formarea ciclohexanului. Ecuația stoechiometrică generală pentru această reacție poate fi reprezentată după cum urmează:

Când este expus la radiații ultraviolete sau la lumina directă a soarelui, benzenul reacționează și cu clorul. Această reacție are loc printr-un mecanism radical complex. Produsul său final este 1,2,3,4,5,6-hexaclorociclohexan:

O reacție similară are loc între benzen și brom sub influența radiațiilor ultraviolete sau a luminii solare.
Oxidare. Benzenul și inelul benzenic din alți compuși aromatici sunt, în general, rezistente la oxidare chiar și prin agenți oxidanți puternici precum o soluție acidă sau alcalină de permanganat de potasiu. Cu toate acestea, benzenul și alți compuși aromatici ard în aer sau oxigen pentru a produce o flacără foarte fumoasă, care este tipică hidrocarburilor cu un conținut relativ ridicat de carbon.

